SK바이오팜, 뇌전증 신약 최종관문 통과…"2분기 美 출시"
미국 마약단속국(DEA) 스케줄 평가 완료
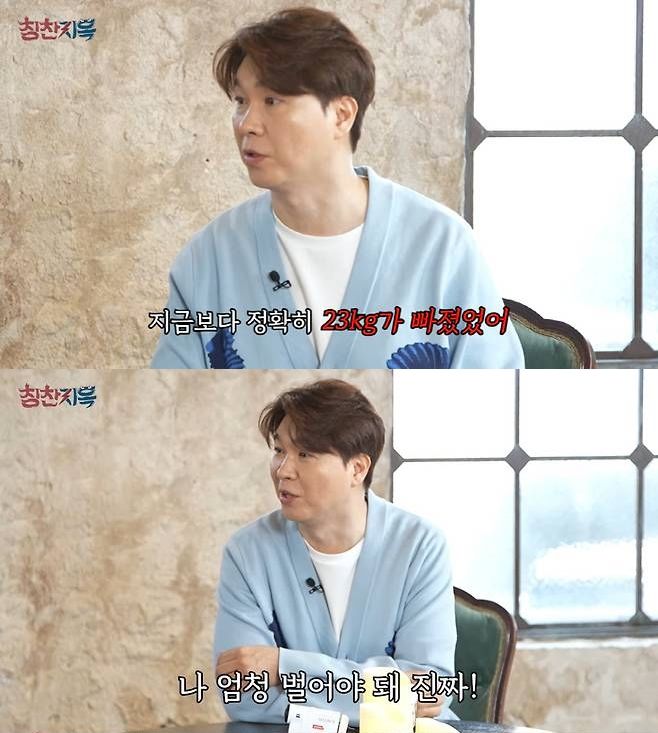
![[서울=뉴시스] 김진아 기자 = 조정우 SK바이오팜 사장이 26일 서울 종로구 SK서린빌딩에서 성인 대상 부분발작 치료제인 뇌전증 신약 '엑스코프리(성분명 세노바메이트)'의 미국 식품의약국(FDA) 시판 허가 기념 기자간담회를 하고 있다. 2019.11.26. bluesoda@newsis.com](http://image.newsis.com/2019/11/26/NISI20191126_0015843712_web.jpg?rnd=20191126105623)
[서울=뉴시스] 김진아 기자 = 조정우 SK바이오팜 사장이 26일 서울 종로구 SK서린빌딩에서 성인 대상 부분발작 치료제인 뇌전증 신약 '엑스코프리(성분명 세노바메이트)'의 미국 식품의약국(FDA) 시판 허가 기념 기자간담회를 하고 있다. 2019.11.26. [email protected]
[서울=뉴시스] 송연주 기자 = SK바이오팜은 독자 개발한 혁신 신약 세노바메이트(미국 제품명 엑스코프리)가 美 DEA(Drug Enforcement Administration, 마약단속국)에서 ‘스케줄(Schedule) V’를 받았다고 11일 밝혔다.
출시를 위한 마지막 행정 절차가 완료됐다는 게 회사 측의 설명이다. 2분기 출시를 목표로 하고 있다.
중추신경계 약물은 미국법에 따라 FDA(식품의약국) 승인 후 약품의 의학적 용도와 남용 및 의존 가능성을 평가해 5개 등급(스케줄 Ⅰ부터 Ⅴ까지)으로 분류하는 절차를 거친다. 세노바메이트는 그 중에서도 남용 가능성이 가장 낮은 스케줄 V를 받았다. 등급에 따라 의약품 관리 수준이 결정된다.
SK바이오팜 조정우 사장은 “DEA의 스케줄 평가를 끝으로 세노바메이트의 미국 시장 출시를 위한 모든 사전 절차를 마쳤다”며 “뇌전증 환자들의 삶의 질 개선을 위해 세노바메이트의 빠른 출시를 위해 노력할 것”이라고 말했다.
세노바메이트는 SK바이오팜이 독자 개발해 작년 11월21일(현지시간) FDA에서 부분 발작 치료제로 허가받은 약물이다. 마케팅과 판매는 회사의 미국 법인 SK라이프사이언스(SK Life Science)가 직접 맡는다. 현재 미국 내 직접 판매를 위한 조직 구축 및 마케팅 계획 등 모든 준비를 마친 상태다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지