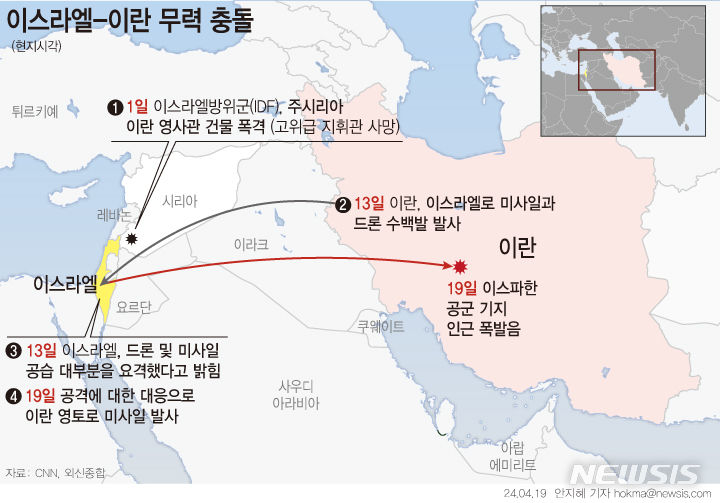
시선바이오, 코로나19 진단키트 수출 허가 획득
FDA 긴급사용승인 신청 및 유럽 승인
![[서울=뉴시스] 시선바이오머티리얼스 코로나19 진단 제품 ‘U-TOP COVID-19 Detection Kit’ (사진=시선바이오머티리얼스 제공)](http://image.newsis.com/2020/04/02/NISI20200402_0000505228_web.jpg?rnd=20200402092736)
[서울=뉴시스] 시선바이오머티리얼스 코로나19 진단 제품 ‘U-TOP COVID-19 Detection Kit’ (사진=시선바이오머티리얼스 제공)
회사 측에 따르면 앞서 지난 2월 유럽 CE-IVD 인증을 받은 후 유럽·중동·동남아 등에 수출을 진행 중이다. 지난달 25일엔 미국 식품의약국(FDA)에 긴급사용승인을 신청했다.
회사 관계자는 “해당 제품은 N 유전자와 RdRp 유전자를 타깃 한다”며 “타깃 검출력이 뛰어난 인공 DNA(PNA)를 이용해 미량의 바이러스를 가진 감염 환자도 조기에 선별 가능하다”고 말했다.
이어 “위양성 및 위음성을 줄여 재검 발생율을 최소화하면서 99% 이상의 정확도를 보인다”면서 “Real-time PCR 결과는 1시간 30분내 확인 가능하다. 전용 분석 프로그램을 통해 결과 확인 및 보고서 도출을 간편화 했다”고 설명했다.
박희경 대표는 “핵심 소재인 PNA는 원재료 확보가 유리해 전 세계에 제품을 제공하는데 문제 없다”면서 “하루에 최소 10만 테스트 이상모 생산이 가능하고 20만 테스트까지 확대할 예정이다. 유럽, 중동 등 30개국과 수출을 진행 중”이라고 말했다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지