코로나19-독감 동시 진단키트 국내 최초 허가(종합)
코젠바이오텍의 유전자 증폭 방식…“이외 5개는 허가 심사 중”
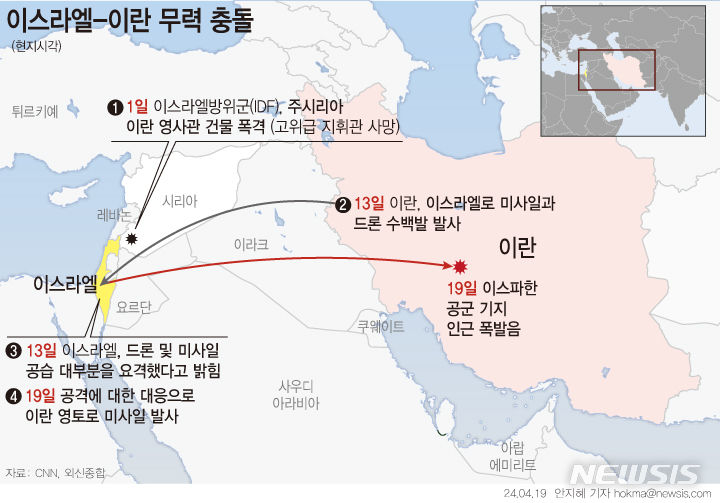
코로나 진단키트 올해 1조4천억 수출…팬데믹으로 새로 창출
160여개국에 3억4723만명분 수출
![[광주=뉴시스] 신대희 기자 = 10일 오전 광주 북구보건소 코로나19 선별진료소에서 의료진이 진단 검사 대상자의 검체를 채취하고 있다. 2020.09.10. sdhdream@newsis.com](http://image.newsis.com/2020/09/10/NISI20200910_0016662851_web.jpg?rnd=20200910154003)
[광주=뉴시스] 신대희 기자 = 10일 오전 광주 북구보건소 코로나19 선별진료소에서 의료진이 진단 검사 대상자의 검체를 채취하고 있다. 2020.09.10.
[email protected]
해당 제품은 코젠바이오텍의 유전자 증폭 방식의 진단키트 ‘PowerChek SARS-CoV-2, Influenza A&B Multiplex Real-time PCR Kit’다. 이 외에도 5개의 동시진단 키트가 허가 신청돼 식약처가 심사 중이다.
이번에 허가받은 동시진단 시약은 기침, 인후통 및 발열 등 증상이 비슷해 구분이 쉽지 않은 코로나19와 인플루엔자를 동시에 진단할 수 있는 제품이다.
이 제품으로 의심 환자의 검체를 검사하는 경우 한 번의 검사로 3~6시간 이내에 진단 결과를 동시에 얻을 수 있다. 검사 시간을 단축하고 빠른 시간 내에 적절한 처치 등 환자의 편의성을 제고하고 의료인의 부담을 덜 수 있다는데 의미가 있다.
이로써 식약처는 코로나19 유전자 진단시약 5개(5개 업체)를 허가했다.
현재 정식 허가를 신청한 진단시약은 유전자 진단시약 14개, 항원 진단시약 5개, 항체 진단시약 11개로 총 30개 제품이 심사 중이다. 이 중 코로나19-독감 동시 진단키트로 신청한 제품은 5개다.
![[서울=뉴시스] 코로나19 진단시약 정식허가 제품현황 (사진=식품의약품안전처 제공)](http://image.newsis.com/2020/11/03/NISI20201103_0000629614_web.jpg?rnd=20201103141736)
[서울=뉴시스] 코로나19 진단시약 정식허가 제품현황 (사진=식품의약품안전처 제공)
코로나19 진단시약은 현재까지 197개 제품(유전자 100, 항원 27, 항체 70)이 수출용 제품으로 허가돼 인도, 미국, 브라질, 이탈리아, 인도네시아, 네덜란드 등 전 세계 160여개 국가에 수출됐다. 수출 물량은 총 3억4723만명분이다.
수출금액은 올해 9월까지 약 1조3956억원(12억200만 달러) 수준이다. 이는 2020년 코로나19 팬데믹으로 새롭게 창출된 수출 규모다.
지난해 체외진단시약 전체 수출액(4855억원)과 비교하더라도 187% 증가했다. 연말까지는 200%를 상회할 것으로 예상되고 있다.
식약처 양진영 차장은 “이러한 신규 수출시장 개척은 국제적으로 인정받은 K-방역의 성과와 맞물려, 국내 제품의 우수성이 원동력이 된 것”이라고 평가했다.
식약처는 코로나19 진단시약 등 품질이 우수한 제품의 신속 개발·허가를 지원하고 있다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지