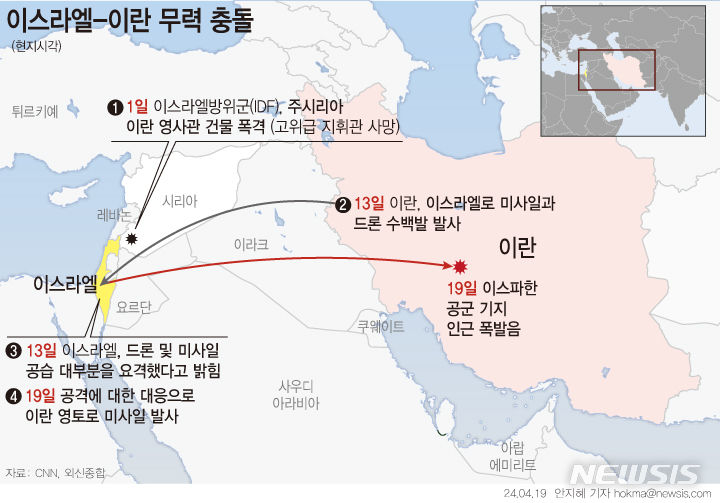
이뮤노포지 "근골격 희귀질환 신약 FDA 임상 2a 승인"
이에 따라 회사는 올해 3분기 중 듀시엔형근이영양증(DMD) 환자 12명을 대상으로 한 미국 2a상의 환자 모집을 시작할 계획이다.
회사에 따르면 앞서 2020년 FDA로부터 이 후보물질의 희귀의약품(ODD) 지정을 받은 바 있다.
듀시엔형근이영양증은 근육단백질을 합성하는 유전자 이상으로 발생해 시간이 지나면서 근력이 약화되는 희귀질환인 근이영양증 가운데에서도 가장 빈도가 높은 유전성 질환이다.
회사 측은 “미국 2a상 승인을 기다리면서 이미 미국 대학병원 및 임상시험수탁기관(CRO)과 임상 준비를 진행하고 있었다”며 “임상기관에서의 IRB(임상연구심사위원회) 승인이 이뤄지는 대로 미국에서 임상을 시작할 예정이다”고 했다.
안성민 이뮤노포지 대표는 “올해 3분기 미국에서 듀시엔형근이영양증 환자 대상 PF1801 글로벌 임상을 시작해 개발을 본격화할 것이다”고 말했다.
한편, 바이오 벤처 이뮤노포지는 기술특례상장을 통해 2025년까지 코스닥 상장을 완료한다는 목표다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지