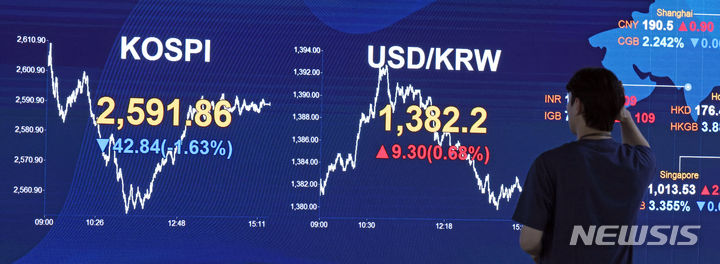
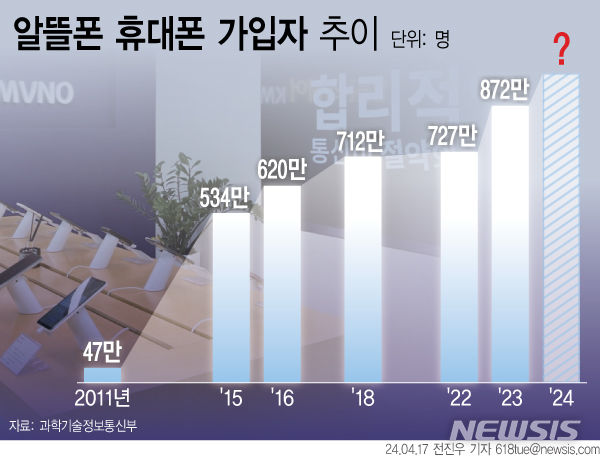
질병세포만 찾아 치료하는 '유전자가위시스템(CRISPR-Cas9)' 개발
KAIST·KIST·강원대 공동연구, 오프-타겟 이펙트 최소화한 '셀프 체크인'
단일 가이드 RNA·메신저 RNA 표적서열 교체 가능…다양한 질병 적용
![[대전=뉴시스] 세포 내 '셀프 체크인'의 마이크로RNA 특이적 작용 모식도. *재판매 및 DB 금지](http://image.newsis.com/2022/06/14/NISI20220614_0001019355_web.jpg?rnd=20220614114041)
[대전=뉴시스] 세포 내 '셀프 체크인'의 마이크로RNA 특이적 작용 모식도. *재판매 및 DB 금지
KAIST는 의과학대학원 이지민 교수 연구팀이 한국과학기술연구원(KIST) 오승자 선임연구원, 강원대학교 이주용 교수와 공동 연구를 통해 질병세포에서만 핵 내 유전자 교정을 수행할 수 있는 유전자가위시스템(CRISPR/Cas9)을 개발했다고 14일 밝혔다.
연구팀은 세포 내 마이크로RNA가 특정 서열을 인식해 절단한다는 특성을 활용, 질병세포에서 과발현되는 마이크로RNA에 의해 특이적으로 절단될 수 있는 링커를 연결한 유전자 가위 시스템을 설계했다.
이렇게 설계된 시스템은 질병세포 특이적 마이크로RNA가 적은 정상세포에서는 세포질에 머물러 유전자 교정을 수행하지 않지만, 질병세포에서는 링커가 절단되면서 유전자 가위가 세포핵으로 들어가 유전자 교정을 수행한다.
정상세포와 질병세포가 혼합된 실제 환자에게 효과적인 유전자 교정 치료를 진행할 수 있을 것으로 기대를 모으고 있는 이번 연구 결과는 국제 학술지 '뉴클레익 엑시드 리서치(Nucleic Acids Research, IF 16.971)' 온라인판에 지난달 30일 게재됐다.(논문명 : Cytosolic microRNA-inducible nuclear translocation of Cas9 protein for disease-specific genome modification)
마이크로RNA는 유전자 전사 후 조절하는 19~24 뉴클레오티드(DNA나 RNA의 기본 단위) 길이의 RNA다. 마이크로RNA는 DNA로부터 전사된 메신저 RNA에 아르고너트(Argonaute) 단백질을 통해 결합하며 결합한 메신저 RNA를 절단한다.
연구팀에 따르면 유전자 가위 시스템은 정교한 유전자 교정을 수행하는 효과적인 도구지만 표적 유전자가 아닌 다른 유전자를 편집하는 '오프-타겟 이펙트(off-target effect)'가 생길 수 있고 다양한 세포가 혼합된 환경에서는 유전자 교정을 수행하기 어렵다는 한계들이 존재한다.
![[대전=뉴시스] 셀프 체크인의 링커 특이적 세포핵 이동 이미지와 항암 약물 시스플라틴(Cis)과의 병행 사용 효과를 보여주는 사진. *재판매 및 DB 금지](http://image.newsis.com/2022/06/14/NISI20220614_0001019379_web.jpg?rnd=20220614125951)
[대전=뉴시스] 셀프 체크인의 링커 특이적 세포핵 이동 이미지와 항암 약물 시스플라틴(Cis)과의 병행 사용 효과를 보여주는 사진. *재판매 및 DB 금지
또 연구팀은 인간 질병세포에서 과발현되는 마이크로RNA-21의 표적 서열과 실험용 쥐의 마이크로RNA-294의 표적 서열을 연결한 유전자 가위의 인간 질병세포 내 유전자 교정 기능을 비교해 마이크로RNA-21 표적 서열 연결 유전자 가위만이 세포 내 마이크로RNA-21에 의해 절단돼 핵까지 전달, 기능을 수행하는 것을 확인했다.
이어 연구팀은 다양한 폐암 세포에서 마이크로RNA-21의 발현량과 발암 단백질 Ezh2가 양의 상관관계가 있다는 것을 증명했고 셀프 체크인을 적용해 마이크로RNA-21이 과발현된 폐암 세포에서 발암 유전자 Ezh2의 유전자 교정을 성공적으로 수행했다.
특히 폐암 세포에서 마이크로RNA-21과 Ezh2의 발현이 항암제(시스플라틴)을 투여하면 오히려 증가한다는 사실을 확인했고 유전자 가위 셀프 체크인 기술을 통한 Ezh2 유전자 교정과 시스플라틴의 병행 사용은 폐암 세포의 성장을 더욱 효과적으로 억제할 수 있음을 마우스 실험을 통해 밝혔다.
이 유전자 가위 셀프 체크인 기술은 질병세포에서만 기능하기 때문에 오프-타겟 이펙트를 최소화할 수 있고 세포 내 시스템 활용으로 안정성도 높다.
연구팀은 단일 가이드 RNA 및 메신저 RNA 표적 서열을 상황에 맞게 교체해 사용할 수 있어 유전자 가위 셀프 체크인 기술이 다양한 질병에 적용될 수 있을 것으로 기대하고 있다.
연구팀은 관계자는 "기존 문제를 개선한 유전자 가위 셀프 체크인 기술은 높은 특이성을 갖고 질병세포에 대한 유전자를 세포 특이적으로 교정할 수 있다"며 "다양한 질병 연관 마이크로RNA에 대응해 기술을 적용할 수 있을 것"이라고 말했다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지