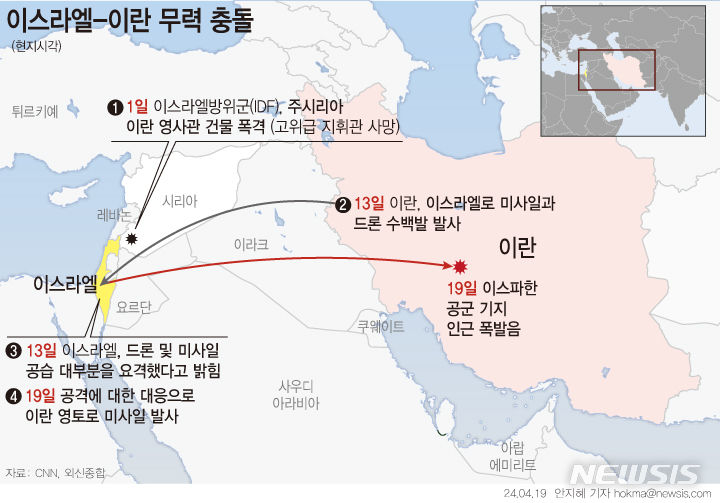
에스티팜, 에이즈 치료제 2a상 계획 美 FDA 승인

[서울=뉴시스] 송연주 기자 = 에스티팜은 미국 식품의약국(FDA)에서 지난 달 30일(현지시간) 에이즈(AIDS·후천성면역결핍증) 치료제로 개발 중인 ‘STP0404’의 임상 2a상 시험계획을 승인받았다고 4일 공시했다.
이번 임상은 HIV-1(인체면역결핍바이러스)에 감염되고 처방을 받지 않은 성인을 대상으로 STP0404의 항바이러스 활성, 안전성, 내약성·약동학을 평가하기 위한 2a상이다.
에스티팜은 36명의 18~65세 성인 환자를 대상으로 STP0404의 항바이러스 활성, 안전성, 내약성 및 약동학을 평가할 예정이다.
STP0404를 10일 동안 매일 1일 1회 복용한 후 항바이러스 활성, 안전성, 내약성 및 약동학을 평가한다.
에스티팜은 "이번 임상을 통해 HIV-1 감염 환자에 대한 STP0404의 항바이러스 활성, 안전성, 내약성 및 약동학적 특성을 확보할 수 있을 것으로 기대한다"며 "이번 임상에서 확인되는 항바이러스 활성 및 안전성 평가 결과에 따라 기술수출 여부를 타진하고 다음 단계 개발 계획을 수립할 예정이다"고 했다.
회사 관계자는 "올해 투약을 개시하면 내년 중 2a상 결과가 나올 것으로 예상한다"고 말했다.
STP0404는 새로운 작용기전의 알로스테릭 에이즈 바이러스 인테그라제 억제제(ALLINIs)다. 인테그라제의 활성부위에 관여하지 않고 비촉매 활성부위를 저해하는 기전을 가진다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지