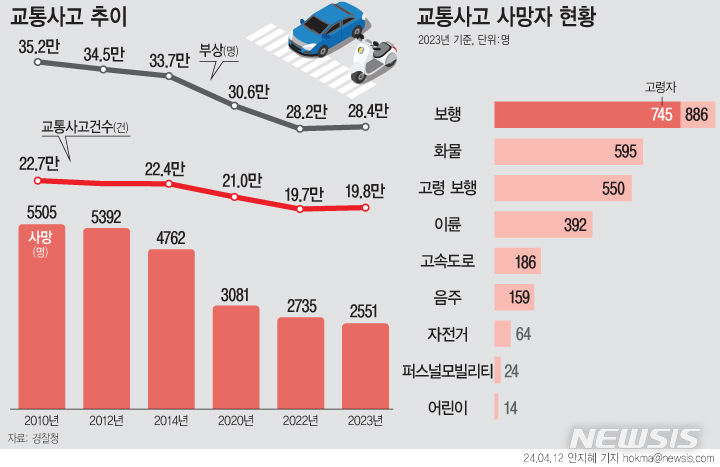
엑세스바이오 "코로나19 분자진단키트, 美 긴급사용승인 허가 획득"

[서울=뉴시스]신항섭 기자 = 엑세스바이오는 미국식품의약국(FDA)에 신청한 코로나19 분잔진단키트 긴급사용승인(Emergency Use Authorizations)이 최종 승인됐다고 9일 밝혔다.
이번에 승인된 코로나19 분자진단키트인 'CareStart™ COVID-19 MDx RT-PCR'는 비 인두 및 인두 면봉 샘플을 통해 'SARS-CoV-2'의 특이 유전자 2개를 증폭시켜 민감도를 높이며, 진단 결과는 2시간 이내에 알 수 있다.
엑세스바이오는 코로나 19 분자진단키트의 미국 판매가 가능해짐에 따라, 본 제품을 미국 현지에서 생산하여 리드타임을 최소화하고 미국 회사로서의 경쟁력을 극대화하겠다는 전략이다.
회사 관계자는 "뉴저지 공장은 기존 신속진단키트(RDT)에 특화된 공장이지만 코로나 확산 초기에 미국 뉴저지 연구소 내 분자진단 생산시설을 신속하게 구축해 분자진단 생산도 가능하게 됐다"며 "본 승인은 엑세스바이오가 선진 시장으로의 판매 비중을 확대하고, 분자진단으로까지 제품군을 확보할 수 있는 중요한 발판이 됐다"고 설명했다.
이어 "그동안 쌓아온 해외 유통채널과 최대주주인 우리들제약의 영업력을 통해 미국 뿐 아니라 글로벌 시장으로의 물량 공급을 확대해 나갈 예정"이라고 덧붙였다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지