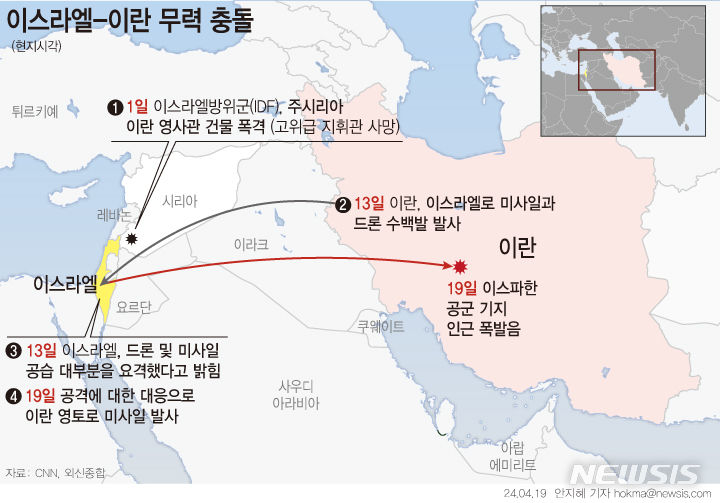
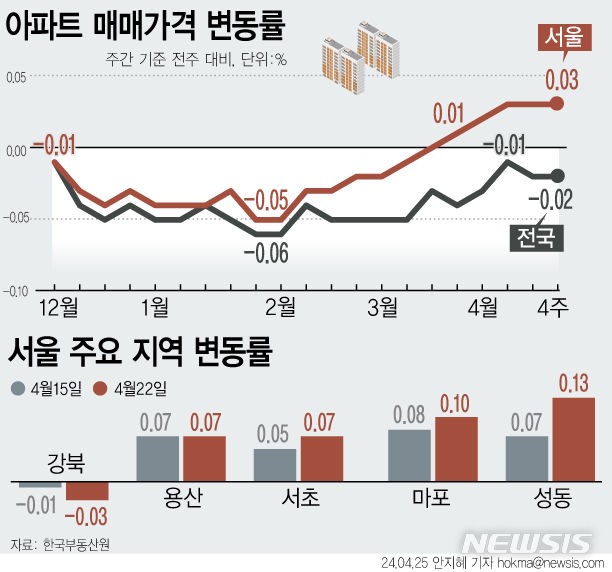
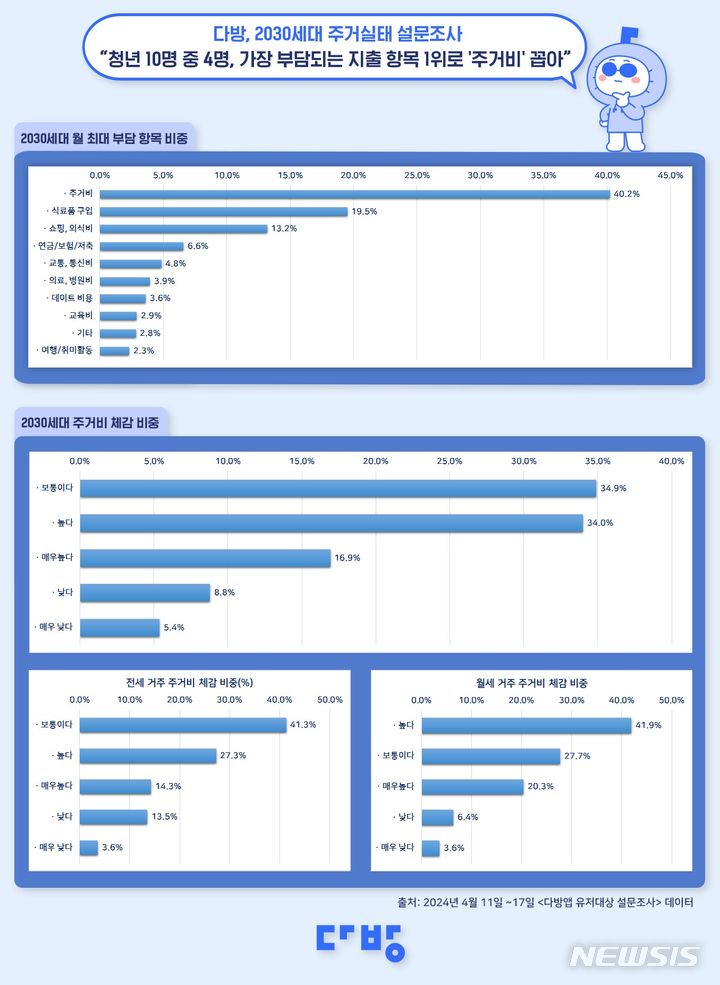
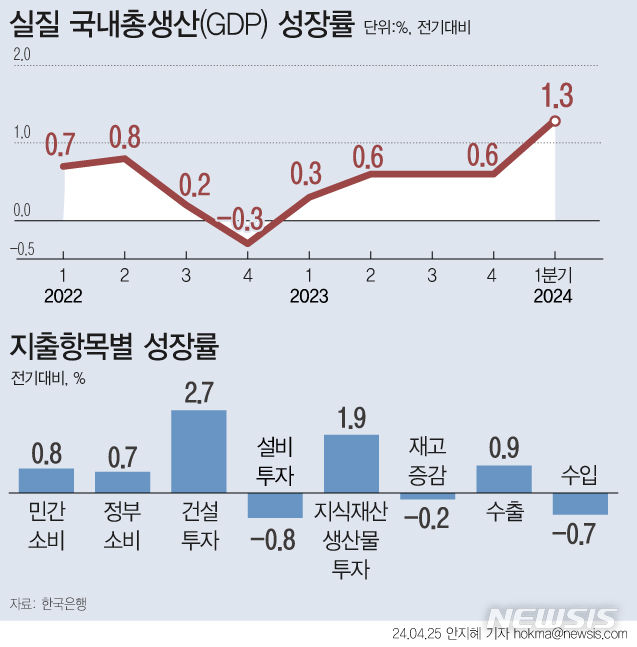
미국 FDA, 휴젤 보툴리눔 톡신 품목허가 심사 착수
심사 기한은 내년 3월31일까지

앞서 휴젤은 지난 3월31일 FDA에 미간주름을 적응증으로 레티보 50유닛(Unit)과 100유닛에 대한 품목허가 신청서(BLA)를 제출한 바 있다.
FDA 발송 공문에 따르면, 전문의약품 신청자 수수료법에 따라 품목허가 심사 기한은 내년 3월31일이다.
약 2조원으로 추정되는 미국 보툴리눔 톡신 시장은 유럽과 함께 5조원 규모 전 세계 시장의 70%를 차지하고 있다. 2029년까지 연평균 약 10%의 높은 성장세를 이어갈 것으로 전망된다.
휴젤은 지난 2018년 10월 오스트리아 에스테틱 전문 제약사 크로마와 미국 현지 자회사 ‘휴젤 아메리카’를 설립, 시장 진입 전략을 구상 중이다.
휴젤 관계자는 “한국 시장에 비해 전체 규모는 크지만 보툴리눔 톡신 제품에 대한 경험률은 낮기 때문에 휴젤의 진출은 미국의 톡신 시장 자체를 확장하는 데 기여할 것이다”며 “전략적인 영업과 마케팅을 통한 현지 시장 수요 확대를 통해 진출 3년 내 현지 TOP 3 브랜드로 도약하겠다”고 말했다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지