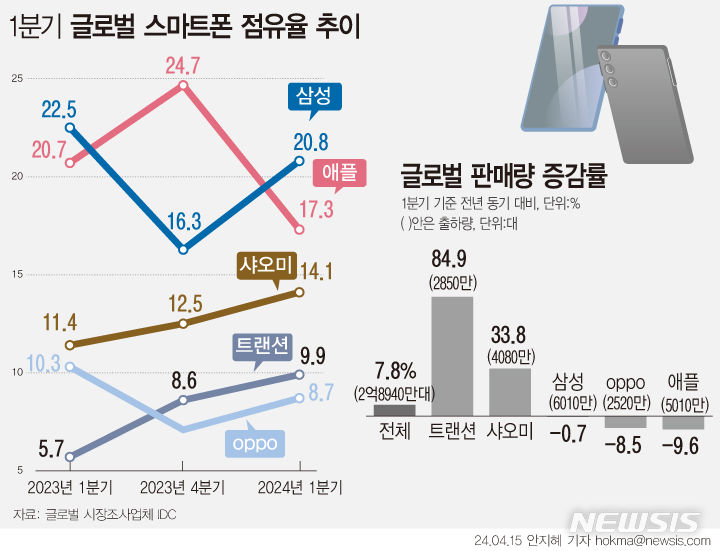
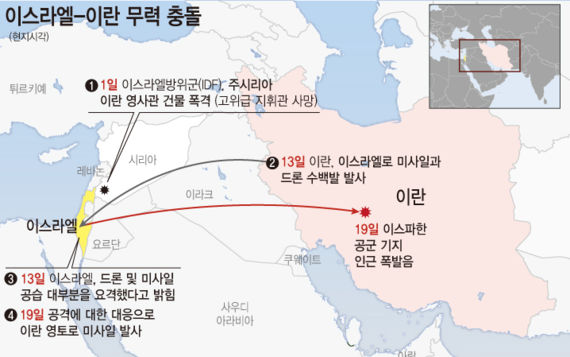
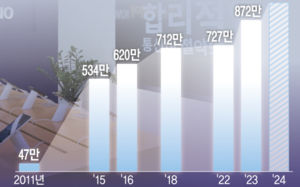
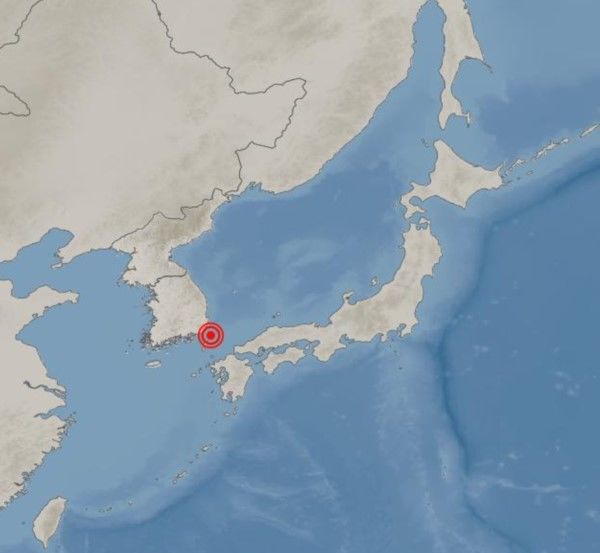
젬백스, 알츠하이머 치료 후보물질 임상 3상 승인
GV1001, 식약처 신청 후 1년만에 임상 승인

젬백스앤카엘 사옥 (사진=젬백스앤카엘 제공) *재판매 및 DB 금지
[서울=뉴시스] 송연주 기자 = 젬백스앤카엘은 지난 14일 식품의약품안전처에서 중등도~중증 알츠하이머병 환자를 대상으로 알츠하이머 치료제로 개발 중인 'GV1001'의 유효성 및 안전성을 평가하는 3상 임상시험을 승인받았다고 17일 밝혔다.
인하대학교병원 등 국내 50여개 병원에서 중등도~중증의 알츠하이머병 환자 936명을 대상으로 시험이 실시될 예정이다.
임상시험의 1차 유효성 평가지표는 GV1001 24주(6개월) 투여 후 중증장애점수(SIB)및 임상치매척도(CDR-SOB) 변화량이다. 24주(6개월)의 이중 눈가림 시험 기간과 이후 24주(6개월) 공개 연장 시험 기간으로 구성된다.
앞서 젬백스는 2017년 8월부터 2019년 9월까지 국내 12개 의료기관에서 실시한 2상에서 중등도~중증 환자의 GV1001 안전성과 유효성을 확인했다고 발표한 바 있다.
그 결과를 바탕으로 2021년 1월27일 3상 임상을 신청했으나 일부 항목에 대한 자료 미비 사유로 반려되자 자료를 보완해 작년 6월24일 재신청해서 이번에 승인받았다.
젬백스 관계자는 “작년 중반부터 2상 임상 결과를 긍정적으로 평가하는 여러 신경과 교수와 3상에 대해 논의해왔으므로 빠른 시간 내 환자 모집이 시작될 수 있을 것이다”고 기대했다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지