헬릭스미스 “엔젠시스, 당뇨병성신경병증 3-2상 추가자료 제출”
미국 독립데이터모니터링위원회에 추가 자료 제출
7월 중 중간결과 발표 예상

헬릭스미스 김선영 대표가 28일 오전 서울 마곡 본사에서 기자간담회를 진행하고 있다. (사진=뉴시스) *재판매 및 DB 금지
【서울=뉴시스】황재희 기자 = 헬릭스미스는 미국 독립데이터 모니터링 위원회(iDMC)로부터 유전자치료제로 개발 중인 ‘엔젠시스’(VM202) 추가 임상 자료 요청을 받았다고 28일 밝혔다. 다만 7월 중 전망했던 당뇨병성 신경병증 적응증(DPN) 3-2상(두 번째 3상) 중간결과 발표는 iDMC로부터 받을 수 있을 것으로 전망했다.
헬릭스미스 김선영 대표는 28일 오전 서울 마곡 본사에서 기자간담회를 개최하고 “오늘 엔젠시스 3-2상 중간결과 발표를 했으면 했는데, iDMC가 추가 자료를 요청했다”며 “오늘 이것에 대해 명확한 결과를 드리는 것은 잠시 유보하고 단지 중간결과라고 하는 것이 얼마나 의미가 있는지에 대해 설명하겠다”고 말했다.
이어 “추가로 요청받은 자료는 안전성과 유효성 데이터 등으로, 분석해가는 과정에서 여러 자료를 확인하는 것”이라고 덧붙였다.
헬릭스미스는 2020년 6월 DPN 3-2상을 개시했다. 이날 기준 환자 152명 중 134명이 등록을 완료했다.
김 대표는 “의뢰자에게는 이중맹검이 유지되기 때문에 임상 종료 시까지는 명확한 유효성 결과를 알 수는 없지만 여러 데이터를 감안할 때 좋은 결과를 얻을 것으로 기대하고 있다”며 “지난 10일 동안 계속 서류들이 (iDMC와)왔다 갔다 하고 있다. 조만간 iDMC로부터 임상 지속, 임상 규모 수정, 임상 중단 3가지 중 1개를 통보받을 것”이라고 설명했다.
헬릭스미스가 진행하는 3-2상은 항경련제 ‘가바펜틴’과 ‘프리가발린’을 복용하지 않는 DPN 환자를 대상으로 엔젠시스를 2회(각각16㎎) 투여하는 방식이다.
1차 평가변수는 180일째 7일 간 평균 통증 수치 변화이며, 2차 평가변수는 180일째 7일 간 최악의 통증 수치 변화 및 통증이 50% 이상 감소한 반응자 비율이다.
박영주 임상부문장은 “90일째와 180일째 취침 전 감각 검사값, 180일째 반응자 비율, 90일째 7일 간의 일간 평균 통증 수치 변화 등을 분석한다”며 “추적기간은 6개월이며, 추가 6개월을 연장해서 안전성을 본다”고 말했다.
iDMC는 엔젠시스가 헬릭스미스의 가설대로 효과가 있어서 임상을 계속해도 되는지(지속), 대상 환자를 152명 이상인 153~250명 사이로 늘릴 것인지(수정), 아니면 임상 중단을 권고할 것인지를 두고 판단하고 있다.
박 부문장은 “iDMC가 만약 임상을 수정하라고 하면 임상 대상자 수를 재설정해서 알려준다”며 “만약 지금 데이터로도 괜찮다면 그대로 진행할 것을 권고하는 것이고, 현재 결과로 봤을 때 진행하는 것이 큰 이익이 없다고 했을 때 임상을 중단하라고 하는 것이다. 다만 이것은 어디까지나 레코멘데이션(권고)이다”라고 말했다.
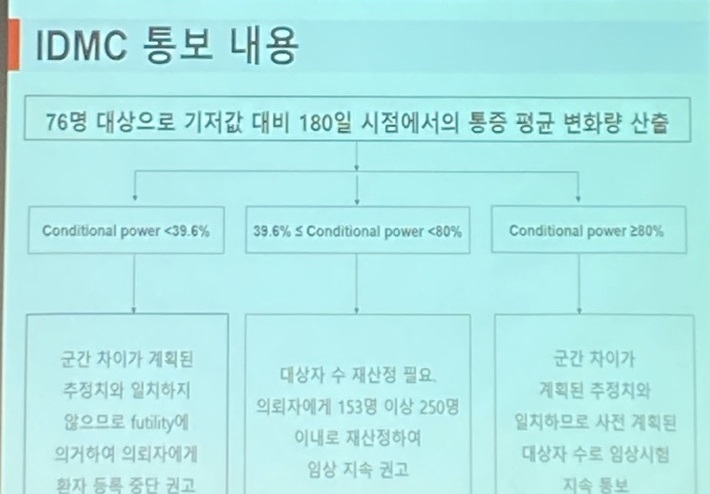
iDMC의 임상 중단·수정·지속의 경우 152명 절반인 76명 환자를 대상으로 ‘기저값 대비 180일 시점에서의 통증 평균량 산출’(conditional power)로 결정한다.
박 부문장은 “76명 대상자에 대한 180일 결과가 모아지면 통계전문가와 데이터관리센터에서 중간분석에 필요한 데이터를 iDMC통계 전문가에게 전달한다”며 “여기서 우리가 검증하려고 하는 것을 몇 퍼센트 확률로 검증할 수 있는지 등을 보는 통계 조건부 검정력을 계산, iDMC와 공유하는 것”이라고 말했다.
그러면서 “이것을 iDMC가 내부적으로 논의, 만장일치를 통해 그 결과를 우리게 통보하는 것”이라며 “컨디셔널 파워가 39.6%보다 낮을 경우 임상 중단을 권고하고, 39.6%이상 80% 미만일 경우 대상자 재선정, 80% 이상일 경우 임상을 계속 할 수 있도록 권고하는 것”이라고 했다.
(사진=뉴시스) *재판매 및 DB 금지
헬릭스미스는 이와 함께 추가 3-3상도 진행할 예정이라고 밝혔다.
3-3상은 3-2상과 유사하지만 치료 횟수를 3회로 늘리고, 대상을 미국뿐 아니라 유럽으로 확장해 진행하게 된다.
김 대표는 “임상 3-1상이 원래 성공했으면 임상을 한 번(3-2상)만 더하면 되는데 우리는 부분적으로 성공했기 때문에 3-3상을 하는 것”이라며 “3-3상은 조만간 시작해서 2024년 이전에 끝날 것으로 본다. 우리는 그 이전에 엔젠시스를 기술 이전하는 것이 목표”라고 말했다.
한편 엔젠시스는 간세포성장인자(HGF) 2가지 동형체(HGF728, HGF723)를 동시에 발현하도록 설계된 플라스미드 DNA 치료제다.
플라스미드는 염색체 DNA와 독립적으로 존재하는 작은 고리형 DNA로, 플라스미드 DNA는 다른 종의 세포로 전달이 가능하며 쉽게 조작·대량생산할 수 있어 유전공학 분야에 널리 사용되고 있다.
HGF는 새로운 혈관을 생성하고 신경 성장과 재생을 촉진하는 등의 다양한 기능을 가진 단백질이다. 엔젠시스를 근육에 투여했을 때 HGF 단백질을 높은 수준으로 생산하도록 한다.
헬릭스미스는 이를 통해 간단한 근육주사로 각종 허혈성질환이나 신경질환에 안전하고 효과적인 치료 효과를 기대하고 있다. 엔젠시스 주요 적응증은 ▲근위축성 측삭경화증(루게릭) ▲당뇨병성 신경병증 ▲당뇨병성 족부궤양 ▲파행증 ▲샤르코마리투스병 ▲관상동맥질환CAD 등이다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지