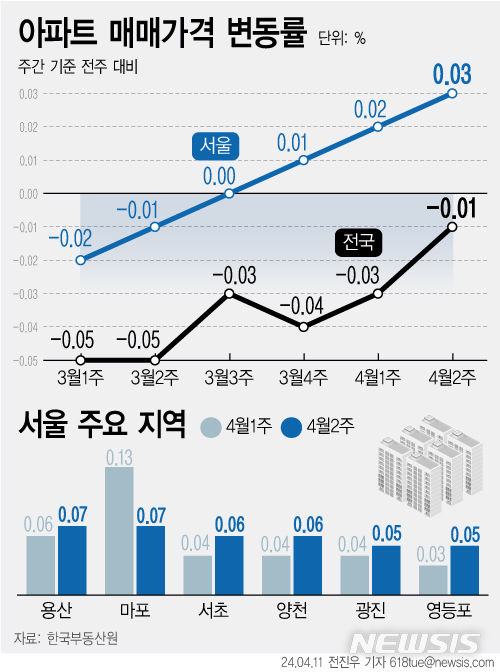
지아이바이옴, 항암 마이크로바이옴 치료제 임상 추진
식약처, ‘GB-104’ 임상 1상 시험계획 승인
![[서울=뉴시스] *재판매 및 DB 금지](http://image.newsis.com/2023/02/06/NISI20230206_0001189444_web.jpg?rnd=20230206083331)
[서울=뉴시스] *재판매 및 DB 금지
[서울=뉴시스]황재희 기자 = 마이크로바이옴 신약개발 기업 지아이바이옴이 항암 마이크로바이옴 치료제 국내 임상 1상에 돌입한다.
지아이바이옴은 식품의약품안전처로부터 항암 마이크로바이옴 치료제 후보물질 ‘GB-104'에 대한 임상 1상 시험계획(IND)을 승인받았다고 6일 밝혔다.
이번 임상은 계획된 표준 치료를 완료한 좌측 대장암인 S자 결장암 및 직장암 환자를 대상으로 GB-104의 안전성과 용량, 대장암 환자의 면역반응과 마이크로바이옴 관련 바이오마커 분석, 암 환자의 삶의 질 개선까지 평가하는 임상이다.
또 수술 방법 중 하나인 ‘저위전방절제술’에 의한 배변곤란 증상을 일컫는 ‘저위전방절제 증후군’(LARS) 개선 여부도 함께 평가한다.
지아이바이옴 관계자는 “GB-104를 항암제로서 개발하는 것만이 아니라 암 환자의 삶의 질 개선을 위한 약제로도 승인이 가능한 투 트랙 초기 임상 결과를 확보하는 전략”이라고 말했다.
마이크로바이옴은 몸 안에 사는 미생물(microbe)과 생태계(biome)를 합친 말로, 인체에 사는 세균, 바이러스 등 각종 미생물을 말한다. 다양하게 변하면서 인간의 질병과 건강에 영향을 미친다.
지아이바이옴에 따르면, GB104는 비임상 시험에서 단독요법 만으로 항암 활성에 중요한 NK세포와 T세포를 종양 조직으로 효과적으로 침투, 대장암을 이식한 동물 모델에서 강한 항암효과를 나타냈다.
김수진 지아이바이옴 임상부문장은 “프랑스 바이오스사에서 생산된 생균제제인 GB104가 다양한 대장암 모델을 이용한 비임상 효력시험에서 단독 및 항암제 병용요법에서 우수한 치료 효능을 확인한 만큼 성공적인 임상 결과를 기대한다”고 말했다.
GB104 임상시험 책임연구자(PI)는 결장암과 직장암 분야 권위자인 삼성서울병원 이우용 암병원장이 맡는다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지