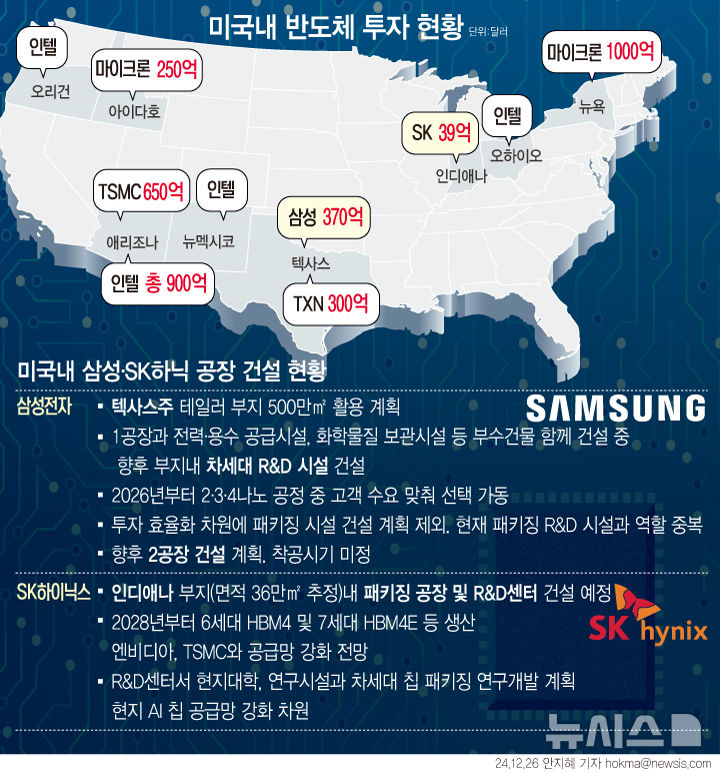
이노테라피, 4등급 지혈제 식약처 품목허가 획득

【서울=뉴시스】 이노테라피는 10일 자사 주요 제품인 4등급 지혈제 '이노씰 플러스'의 상용화를 완료하고 식품의약품안전처로부터 품목허가를 받았다고 공시했다. 2019.10.10. (사진=뉴시스DB) [email protected]
지난 2월 기술특례제도를 통해 코스닥에 상장한 이노테라피는 접착고분자 기술에 기반한 지혈제 제품에 100억원 이상의 연구 개발비를 투자해 상용화 연구를 진행해왔다.
상장 당시 체외에 사용할 수 있는 2등급 제품 '이노씰'의 국내 및 미국 식품의약국(FDA) 허가를 받았으며 본격적으로 다양한 수술 및 적응증에 사용할 수 있는 체내용 4등급 제품군의 해외 임상개발과 출시를 목표로 공모자금을 사용하겠다고 밝힌바 있다.
2등급 제품 이노씰이 체외용 제품으로 국내시장은 연간 약 200억원, 세계시장은 연간 약 3000억원 수준인데 반해 체내용으로 사용하는 4등급 제품은 국내 약 1000억원, 세계 약 7조원으로 20배 이상의 시장 규모를 갖고 있다.
혈액 응고단백질을 사용하는 기존 피브린계 외국산 지혈제와 달리 이노씰 플러스는 인체의 혈액응고 메커니즘과 독립적으로 작동하기 때문에 지혈이 잘 되지 않는 만성 심혈관질환자, 아스피린 복용환자, 당뇨병 환자, 외상 환자 등에게도 작동할 수 있는 범용 제품이어서 성장 가능성이 높다는 게 회사 측 설명이다. 특히 글로벌 1위 피브린계 제품인 전문의약품 타코실과 비교임상을 진행해 주목을 받은 바 있다.
이문수 이노테라피 대표이사는 "이번 품목허가는 당사가 원천특허를 보유한 신물질에 대해 안전성 및 임상적 유효성을 입증했다는 데 주목할 필요가 있다"며 "4등급 제품을 출시할 수 있어 본격적인 매출 기반을 확보함과 동시에 당사의 신물질에 대해 최초로 체내용 허가 사례를 만들게 돼 추가적인 개선제품 출시나 해외허가 획득에 용이해질 것"이라고 전망했다.
또 "글로벌 의료기기 허가 가이드라인에 대응해 ISO13485 품질인증도 확보해 글로벌 시장 진출의 인프라를 탄탄히 마련해오고 있다"며 "이번 품목허가를 바탕으로 내년에는 CE 등 해외 허가를 추진하고 해외시장 진출을 본격화할 계획"이라고 말했다.
한편 이노테라피는 최근 새로운 연구를 통해 자사 플랫폼 기술이 모든 단백질과 접착할 수 있다는 점을 발견했으며 이에 기반해 향후 새로운 유전자 치료제 개발 및 유전자 치료제의 전달 기술 개발로 사업 영역을 확장할 계획이라고 밝혔다.
[email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지