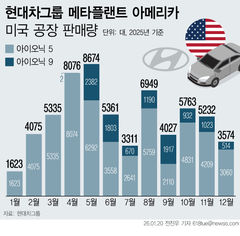
식약처, 화이자 코로나19 2가백신 허가심사 착수
초기 코로나19 바이러스와 BA.1 항원 발현
12세 이상에 사용…추가 접종용으로 개발

[서울=뉴시스] 안호균 기자 = 식품의약품안전처가 29일 화이자의 BA.1 변이용 코로나19 2가 백신에 대한 품목허가 심사에 착수했다.
식약처는 한국화이자제약사가 초기 코로나19 바이러스와 변이 바이러스(오미크론주 변이 BA.1) 항원을 각각 발현하는 메신저리보핵산(mRNA) 방식의 2가백신 수입 품목허가를 이날 신청함에 따라 해당 품목에 대한 심사에 착수했다고 밝혔다.
화이자가 품목허가를 신청한 '코미나티2주0.1mg/mL'의 효능·효과는 ‘12세 이상에서 'SARS-CoV-2' 바이러스에 의한 코로나19의 예방’이다. 기초접종 이후 추가 접종에 사용하기 위해 개발됐다.
식약처는 "이번 품목허가 신청 시 제출된 임상·비임상·품질·GMP(제조품질관리기준) 자료 등을 신속하고 면밀하게 검토하고, 감염내과 전문의를 포함한 백신 전문가에게 해당 백신의 안전성·효과성에 대해 자문한 후 허가 여부를 결정할 예정"이라고 전했다.
앞서 식약처는 화이자가 5일 '코미나티2주0.1mg/mL'의 임상 자료에 대한 사전검토를 신청함에 따라 검토를 진행 중이었다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지