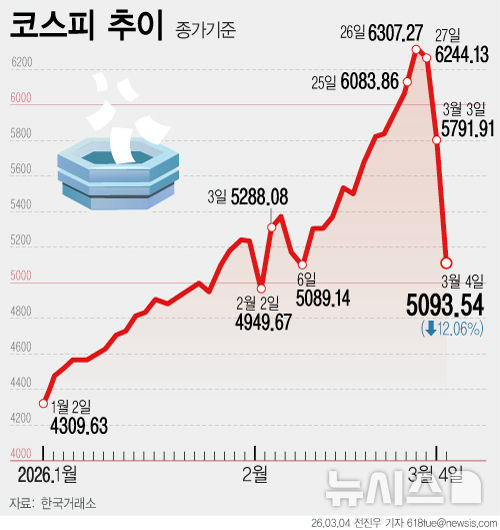
EU, 승인 권고 하루만에 셀트리온 '렉키로나' 정식허가…"유럽 두 번째 코로나 치료제"
통상 1~2개월 걸리는 기간 축소해 권고 하루만에 정식 승인
"30여개국과 허가 신청 및 판매 협상 중"
셀트리온헬스케어 '렉키로나' (사진=셀트리온헬스케어 제공) *재판매 및 DB 금지
[서울=뉴시스] 송연주 기자 = 셀트리온의 코로나19 항체치료제 '렉키로나'(성분 레그단비맙)가 유럽의약품청(EMA) 산하 약물사용자문위원회(CHMP)에서 승인 권고를 받은 지 하루만에 정식 시판허가를 받았다.
유럽의약품청(EMA)은 12일(현지시간) 성명을 통해 셀트리온의 렉키로나와 로슈·리제네론의 코로나19 치료제 '로나프레베'가 EU에서 승인됐다고 밝혔다.
전날 유럽의약품청(EMA) 산하 약물사용자문위원회(CHMP)에서 승인 권고 의견을 받은 지 하루만의 이례적인 승인이다. 통상적으론 CHMP의 승인 권고를 받고 1~2개월 후 유럽연합 집행위원회(EC)에서 최종 승인 여부를 결정하지만 팬데믹 상황에서 신속하게 치료 옵션을 확보하기 위한 결정으로 보인다.
셀트리온 관계자는 "CHMP의 권고 후 이례적으로 하루만에 정식한 허가한 건 확진자가 계속 증가하는 유럽에서 치료제 옵션을 빠르게 확보하기 위한 취지로 보인다"며 "많은 환자가 조기에 치료받을 수 있도록 글로벌 공급에 최선을 다하겠다"고 말했다.
승인에 따라 렉키로나는 길리어드사이언스의 '렘데시비르' 이후 정식 허가받은 유럽 내 두번째 코로나19 치료제가 됐다. EMA 승인을 획득한 최초의 국산 항체 신약이란 타이틀도 얻었다. 코로나19가 확진된 성인(만 18세 이상) 중 보조적인 산소 공급이 필요하지 않고 중증으로 이환 가능성이 높은 환자에 사용될 예정이다.
렉키로나는 13개국 코로나19 경증 및 중등증 환자 1315명을 대상으로 실시한 임상 3상 결과 고위험군 환자에서 중증환자 발생률을 위약군 대비 72% 줄였다. 임상적 증상 개선 시간 역시 고위험군 환자에서 4.7일 이상 단축시켰다.
해외 공급을 위한 절차도 가속화될 전망이다. 렉키로나의 해외 판매를 맡은 셀트리온헬스키어는 전날 승인 권고를 받은 후 "현재 유럽, 아시아, 중남미, 중동 등 글로벌 30여개 국가와 렉키로나 허가신청 및 판매 협상을 진행 중이다"며 "전세계적으로 높은 신뢰도와 영향력을 지닌 EMA의 사용 승인을 앞두고 있어 협의가 더욱 가속화될 것으로 예상된다"고 말했다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지