식약처 “2021년 임상시험 승인 842건, 증가세 지속”
식약처-국가임상시험지원재단, 2021년 의약품 임상시험 승인 현황 발표

(사진=식품의약품안전처 제공) *재판매 및 DB 금지
【서울=뉴시스】황재희 기자 = 식품의약품안전처와 국가임상시험지원재단은 ‘2021년 의약품 임상시험 승인 현황’을 발표하고, 임상시험 증가세가 이어지고 있다고 28일 밝혔다.
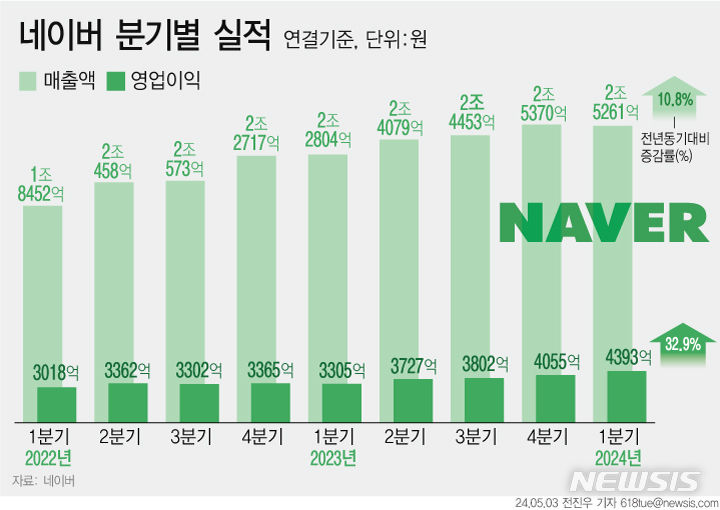
작년 임상시험 승인 건수는 842건으로, 전년 799건 대비 5.4% 증가했다. 2019년에는 714건으로, 최근 3년간 꾸준히 증가하고 있는 것으로 나타났다.
작년 국내에서 승인된 임상시험 주요 특징은 ▲제약사 주도 임상시험 증가세 ▲국내 개발 의약품의 다국가 임상시험 증가 ▲호흡기계·심혈관계 분야 임상시험 크게 증가 ▲코로나19 치료제·백신 임상시험 전년 대비 유사수준 등이다.
작년 전체 국내 임상시험 842건 중 ‘제약사 주도 임상시험’은 679건(80.6%)으로, 2020년 611건 대비 11.1% 상승했다.
반면 연구자가 외부 제약사 등의 시험 의뢰 없이 학술연구 등을 목적으로 수행하는 ‘연구자 임상시험’은 전년 대비 다소 감소(25건↓)했다.
작년 제약사 주도 임상시험 679건 중 다국가 임상시험이 412건(60.7%)으로, 전년도 355건 대비 16.1% 늘어나 전체 임상시험의 증가를 주도했다.
다국가 임상시험 중 원 개발자가 국내 제약사인 경우는 27건(6.6%)으로, 2020년 15건(4.2%) 보다 증가했다. 코로나19 백신·치료제, 항암제, 내분비계 치료제 등 다양한 종류의 국내 제약사 개발 의약품이 다국가 임상시험으로 승인을 받은 것이다.
작년 다국가 임상시험 단계의 경우 2020년 대비 1상은 동일수준, 2상이 31.3%, 3상이 12.5% 상승했고, 전년도에 이어 1·2상 초기임상 비중(53.4%)이 3상 후기임상의 비중(43.7%)을 앞섰다.
작년 전체 임상시험을 효능별로 살펴보면, 호흡기계(36건)와 심혈관계(90건)가 2020년 대비 각각 111.8%, 50.0% 증가해 효능별 임상시험 건수 증가율 1, 2위를 차지했다.
호흡기계는 해외 제약사의 신약 임상시험 중심으로, 심혈관계는 국내 제약사의 새로운 염·조성·용법·용량 개발 위주로 증가했다.
효능별 전체 순위는 항암제(321건), 심혈관계(90건), 내분비계(62건), 감염병(항생제)(60건) 순이었다. 항암제 임상시험은 전체 임상시험의 38.1%를 차지했고, 이 중 특정 표적인자만을 선택적으로 공격하는 ‘표적항암제’가 201건으로, 2020년 164건 대비 22.6% 상승한 것으로 확인됐다.
작년 코로나19 치료제·백신 임상시험은 32건으로, 코로나19 상황이 지속됨에 따라 관련 임상시험도 전년도 37건과 유사한 수준으로 수행됐다.
작년 국내 임상시험 글로벌 순위는 6위로, 2020년과 동일한 순위를 기록했다.
식약처는 글로벌 임상시험 순위를 유지하고, 다국가 임상시험과 난이도가 높은 초기 단계 임상시험이 증가한 것은 국내 임상시험 수행역량을 전 세계적으로 인정받고 있기 때문으로 해석된다고 설명했다.
국가임상시험지원재단 관계자는 “작년 코로나19 유행 속에도 국내 임상시험이 차질 없이 안전하게 수행될 수 있도록 적극적으로 지원해왔으며, 앞으로도 신·변종 감염병 대비는 물론 암·희귀질환 치료제 개발을 위한 공익적 임상시험 지원을 강화하겠다”고 말했다.
식약처 관계자는 “임상시험 지원과 함께 임상시험 참여자 권익 보호와 안전관리 강화에도 적극 노력하고, 최근의 감염병 유행으로 대면 임상시험이 어려운 임상시험의 환경변화 등에도 유연하게 대응하기 위해 제도개선을 선제적이고 지속적으로 추진하겠다”고 했다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지