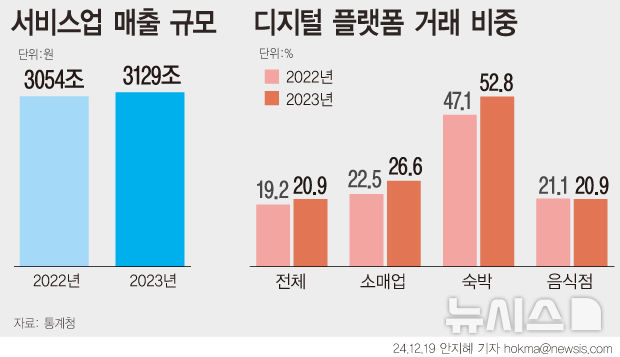
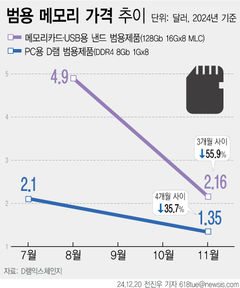
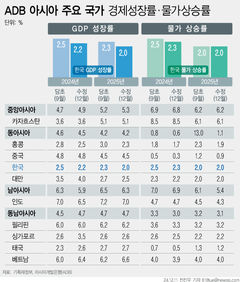
식약처, '의료기기 우수제조' 현장조사 6년 주기로 늘려
의료기기 제조소 대상, 기존 3년서 조정해 현장심사 부담 해소
품질관리 우수제조소에 대한 정기심사 시 서류검토로 우선심사
![[서울=뉴시스] 5일 식품의약품안전처는 '식의약 규제혁신 3.0 과제'인 '품질시스템 우수제조소 정기심사 현장조사 주기 완화' 등의 내용을 담은 의료기기 제조 및 품질관리 기준(식약처 고시) 개정안을 행정예고한다고 밝혔다. 이에 대한 의굔은 오는 26일까지 받는다.(사진=뉴시스DB) 2024.01.10. photo@newsis.com *재판매 및 DB 금지](https://img1.newsis.com/2024/01/10/NISI20240110_0001456600_web.jpg?rnd=20240110164124)
[서울=뉴시스] 5일 식품의약품안전처는 '식의약 규제혁신 3.0 과제'인 '품질시스템 우수제조소 정기심사 현장조사 주기 완화' 등의 내용을 담은 의료기기 제조 및 품질관리 기준(식약처 고시) 개정안을 행정예고한다고 밝혔다. 이에 대한 의굔은 오는 26일까지 받는다.(사진=뉴시스DB) 2024.01.10. [email protected] *재판매 및 DB 금지
[서울=뉴시스]송종호 기자 = 앞으로 의료기기 제조소에 대한 현장 심사가 우수 제조소의 경우 현장 조사 이후 차기 정기심사는 서류검토로 우선심사, 현장조사 주기는 6년으로 조정된다. 제출자료도 6종으로 간소화한다. 현장심사에 대한 부담감을 해소하기 위한 조치다.
식품의약품안전처는 '식의약 규제혁신 3.0 과제'인 '품질시스템 우수제조소 정기심사 현장조사 주기 완화' 등의 내용을 담은 의료기기 제조 및 품질관리 기준(식약처 고시) 개정안을 행정예고한다고 5일 밝혔다. 이에 대한 의견은 오는 26일까지 받는다.
주요 개정 내용은 ▲품질시스템 우수제조소에 대한 정기심사 시 서류검토로 우선심사 ▲제조·품질관리기준 적합성 인정 심사 판정기준 국제조화 ▲선임품질심사원 자격요건 등 품질심사기관 관리운영기준 개선 등이다.
기존에 의료기기 제조소는 품질관리 이력에 대한 고려 없이 3년마다 일괄 정기적으로 현장 조사를 받아야 했으나 앞으로 우수 제조소에 한해 중복 현장심사에 대한 부담감이 크게 줄어들게 됐다.
또한 의료기기 제조·품질관리기준(GMP) 적합성 인정 심사 시 품질에 미치는 영향을 고려하도록 판정기준을 개선한다. 이에 따라 품질시스템에 미치는 영향이 적고 발생 빈도가 적은 경미한 보완사항의 경우 일정 기한 내 시정조치를 완료하는 조건으로 우선 판매가 가능하게 된다.
아울러 선임 품질심사원의 자격요건을 기존 국내 심사경력에서 국외심사 경력까지 확대 인정하도록 개선해 다양한 분야의 숙련된 전문인력을 확보하고, 품질심사원의 자격 유지를 위해 식약처가 정한 교육을 이수하도록 규정한다.
식약처는 "이번 개정안이 의료기기 분야 규제 자원 낭비를 줄이고 신속한 제품 유통 환경을 조성하며 품질심사업무의 신뢰성·전문성을 강화하는 데 도움이 될 것으로 기대한다"라고 밝혔다.
이어 "앞으로도 의료기기 제조·품질관리(GMP) 제도 운영의 내실을 기하기 위한 경쟁력 있는 제도 지원 방안을 지속적으로 마련·추진하겠다"고 덧붙였다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지