제네릭 품질심사 32%만 한번에 통과…보완 1위는 '이것'
'제조방법 관련 자료' 보완 요청 가장↑
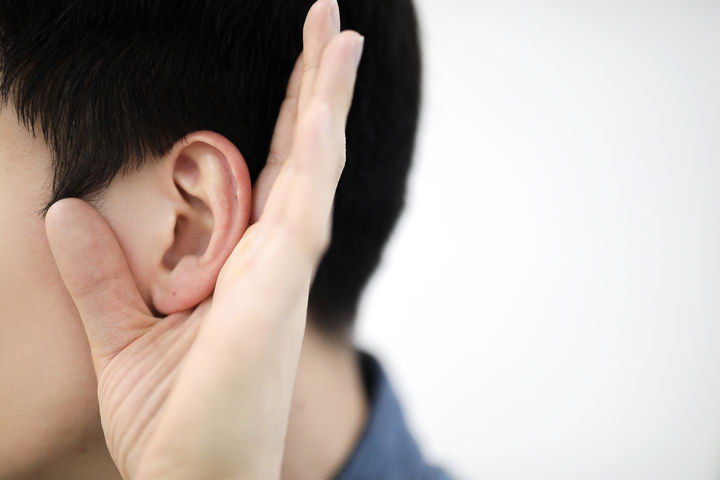
![[서울=뉴시스] 완제의약품 및 원료의약품 보완사항 분류 (사진=식약처 제공) 2024.11.01. photo@newsis.com *재판매 및 DB 금지](https://img1.newsis.com/2024/11/01/NISI20241101_0001691844_web.jpg?rnd=20241101093809)
[서울=뉴시스] 완제의약품 및 원료의약품 보완사항 분류 (사진=식약처 제공) 2024.11.01. [email protected] *재판매 및 DB 금지
[서울=뉴시스]황재희 기자 = 제네릭(복제약) 품질심사 시 32%의 의약품만 한 번에 통과되는 것으로 나타났다.
1일 식품의약품안전처 ‘제네릭의약품 품질심사 주요 보완사례집’에 따르면, 제네릭의약품 품질심사 시 보완 없이 적합 판정을 받은 품목이 32.2%, 1차 보완 후 적합 판정 품목이 48.1%, 2차 보완 후 적합 판정 품목이 19.7%로 확인됐다.
식약처는 최근 제네릭의약품 품질심사 시 개발사 시행착오를 줄이고, 신속한 개발을 지원하기 위해 제네릭의약품 품질심사 주요 보완사례집을 발간했다.
이번 사례집은 식약처 소속 식품의약품안전평가원(이하 평가원)이 지난해 1월부터 올해 6월까지 심사한 제네릭의약품 보완 요청사항을 분석한 결과다. 업계가 품질 심사자료를 준비하는데 활용할 수 있도록 품질심사 시 자주 발생하는 주요 보완사항에 대해 보완요청 사유와 제출 자료 요건, 관련 규정 및 가이드라인을 담았다.
사례집을 보면, 평가원이 심사한 의약품 총 2792 품목 중 1892 품목은 보완요청(67.8%)을 받았다.
완제의약품 주요 보완 요청사항은 ▲제조방법 관련 자료(27.4%) ▲기준 설정 등 품질관리(24.8%) ▲개발경위(20.4%) ▲개요와 조성(9.1%), 첨가제 관련 자료(7%) 순이었다.
제조방법 관련 자료의 경우 ‘의약품의 품목허가·신고·심사 규정’ 개정에 따라 제조방법에 대한 허가 후 변경관리가 강화됐기 때문으로 파악된다.
원료의약품 주요 보완 요청사항은 ▲제조방법 관련 자료(33.1%) ▲분해생성물 특성 등 불순물에 대한 자료(22.2%) ▲품질관리 규격 기준 설정 자료(20.2%) 순이었다. 불순물 관련 보완 중에서는 유전독성물질에 대한 보완요청이 37.4%로 가장 많았고, 유기유연물질(28.1%), 금속물질(17.9%), 잔류용매(16.5%) 순으로 확인됐다.
식약처 관계자는 “이번 보완사례집이 제네릭의약품의 신속한 시장진입에 도움을 줄 것으로 기대하며, 앞으로도 업계와 지속적으로 소통하고 우수한 품질의 제네릭의약품 개발을 적극 지원해 국민 건강 증진에 기여할 수 있도록 하겠다”고 말했다.
사례집의 자세한 내용은 식약처 대표 누리집에서 확인할 수 있다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지