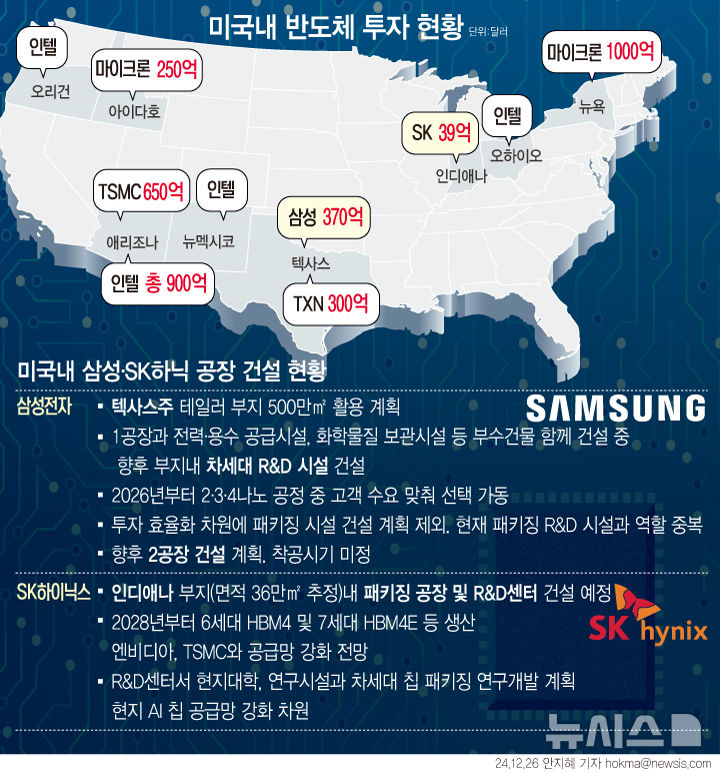
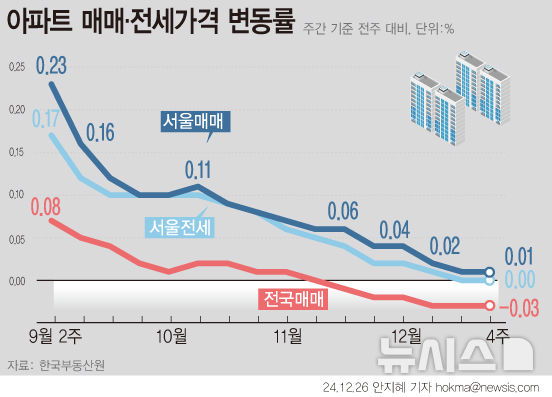
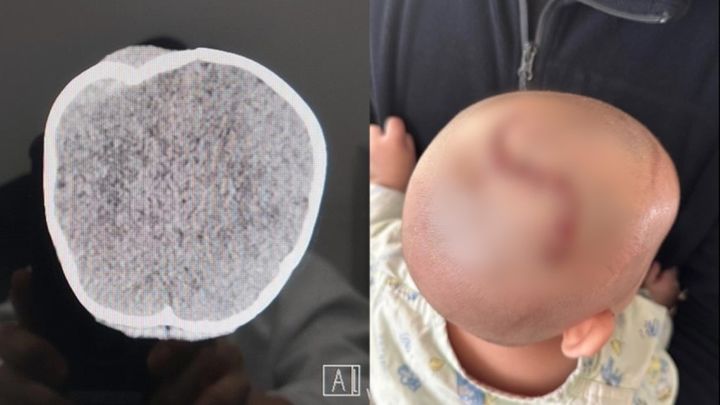
아이진, 수막구균 4가백신 국내 3상 신청…"상용화 목표"
유바이오로직스서 들여온 백신
한국비엠아이와 공동개발 착수
![[서울=뉴시스] 아이진 로고 (사진=뉴시스 DB) photo@newsis.com *재판매 및 DB 금지](https://img1.newsis.com/2023/06/12/NISI20230612_0001287453_web.jpg?rnd=20230612113523)
[서울=뉴시스] 아이진 로고 (사진=뉴시스 DB) [email protected] *재판매 및 DB 금지
[서울=뉴시스]황재희 기자 = 바이오의약품 개발 기업 아이진이 수막구균 4가 백신 ‘EG-MCV4’ 임상 3상에 나선다.
아이진은 식품의약품안전처에 EG-MCV4 국내 임상 3상 계획을 신청했다고 4일 밝혔다.
이번 임상시험은 수막구균 감염 이력이 없는 만 18세 이상부터 만 55세 이하 건강한 남녀에게 EG-MCV4 시험군 약 400명과 대조군 약 400명에게 EG-MCV4와 대조약(멘비오)을 각각 단회 투여하고, 6개월간 관찰해 대조약과 비열등성의 면역원성, 안전성을 확인하는 임상이다.
EG-MCV4는 4개의 수막구균 혈청형(A, C, W-135, Y군)이 CRM197 단백과 접합된 4가 수막구균 단백 접합 백신으로, 주로 뇌수막염으로 대표되는 수막구균 감염에 의한 침습성 질환을 예방한다. 국내 허가된 멘비오(GSK), 메낙트라주(사노피)와 동일한 혈청형을 포함하고 있다.
아이진은 EG-MCV4 사업화를 위해 지난 7월 유바이오로직스로부터 수막구균 4가 백신의 허가 임상 개발 및 독점판매 계약을 체결한 바 있다.
임상 3상 후 2026년 말까지 품목 허가를 획득해 2027년부터 한국 및 PAHO(범 아메리카 보건기구)를 통한 중남미 등 중진국 시장, 중국, 일본 및 동남아시아 시장에 순차적으로 진출할 계획이다.
아이진 관계자는 “EG-MCV4는 국내 기술로 개발된 백신으로서는 최초 상용화를 목표로 하고 있다‘며 ”이전까지 대형 제약사에 라이센싱 아웃 계약 방식의 사업을 시도하던 기존의 아이진 방식과는 달리 임상 3상을 수행한 뒤 직접 생산 판매를 계획하고 있어 2027년부터는 직접적인 매출과 수익 발생할 것“이라고 말했다.
이를 위해 대규모 GMP(우수의약품제조품질관리기준) 생산 공장을 보유한 한국비엠아이와 이번 임상 단계부터 공동개발에 착수한다.
한편 한국보건산업진흥원(KHIDI)에 따르면, 수막구균 백신 글로벌 시장규모는 2021년 약 30억 달러(한화 약 4조11억 원)였으며, 2027년까지 연평균 9.1% 증가해 51억 달러(약 6조8018억 원)까지 늘어날 것으로 예상된다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지