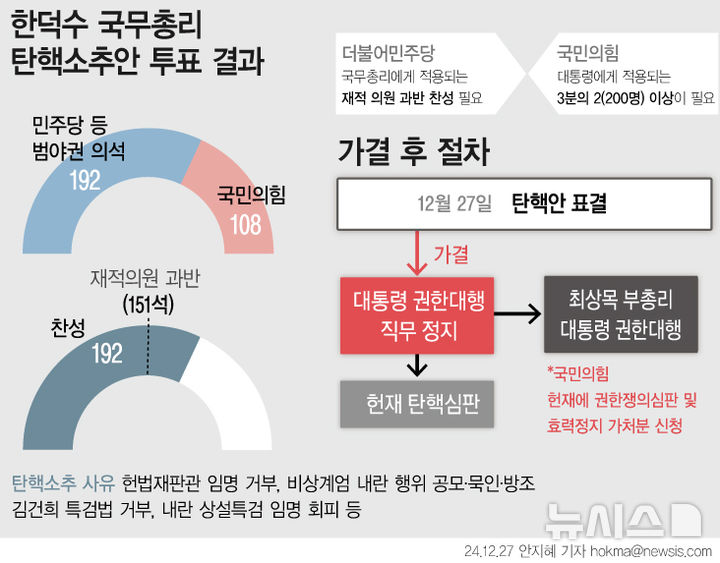
당국 "국산 백신 개발 가장 큰 고비 맞아…내년 활용 가능"
"mRNA 백신 개발 모범…자발적 참여 기대"

SK바이오사이언스가 10일 코로나19 백신 'GBP510'의 임상시험 3상을 승인받았다. 사진은 SK바이오사이언스 연구원이 백신 개발을 위해 실험을 진행하고 있는 모습.(사진 : SK바이오사이언스 제공) *재판매 및 DB 금지
[서울=뉴시스] 구무서 기자 = 당국은 임상 3상에 진입한 국내 기업의 코로나19 백신 개발이 가장 큰 고비를 맞았다면서도, 내년 중에는 활용이 가능할 것이라고 전망했다.
권준욱 질병관리청 중앙방역대책본부(방대본) 제2부본부장은 16일 오후 충북 오송 질병관리청에서 브리핑을 열고 "지난주 SK바이오사이언스가 비교 임상을 통한 임상 3상 승인을 받았다"라며 "이제 백신 개발의 마지막 단계이자 가장 큰 고비를 맞았다"라고 말했다.
SK바이오사이언스가 개발 중인 합성항원 형태의 코로나19 백신은 식품의약품안전처(식약처)로부터 지난 10일 임상 3상 승인을 받았다.
통상 신약은 안전성과 효과성을 검증하는 1상과 2상을 거쳐 3상을 통과하면 시판된다.
권 제2부본부장은 "우리나라 입장에서 선진국은 물론이고 일부 나라들에 비해서도 3상 진입이 늦은 것은 안타까운 상황"이라며 "어떻든 이는 그동안 우리의 투자·관심·노력의 부족이며 이미 과거지사"라고 말했다.
이어 권 제2부본부장은 "이제는 앞으로가 중요하다"라며 "백신 개발을 포함해서 모든 의·과학적 분야의 연구개발이 꼭 성공이 함께하지는 않지만 목표는 분명하고, 개발자는 전력과 혼신을 다해서 노력하고 있고, 당국에서도 최대한 지원하고 모든 면에서 협업을 할 준비가 갖춰져 있다"라고 강조했다.
권 제2부본부장은 "비교임상에도 난관이 많고, 이후 승인 절차에 응하는 것도 많은 준비와 관리가 필요하다"라며 "그렇지만 임상 1상의 결과나 또 과거 실적을 볼 때 최대한 이른 시기에 좋은 결과를 거둘 것이라고 희망하며, 내년 중에 국내에서의 활용이 가능하리라고도 생각한다"라고 말했다.
그러면서 그는 "이번 과정이 향후 국내에서 mRNA 백신 개발에도 선례와 모범이 될 것"이라며 "백신 임상과 관련된 분야에 많은 자발적 참여를 기대한다"라고 말했다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지