HLB, '美신약승인 또 불허' 쇼크…진양곤 "주주실망 죄송"
FDA, 파트너사 '캄렐리주맙' 제조공정 추가 보완 요구
"5월 보완서류 제출…'클래스1'시 7월내 허가 기대해"
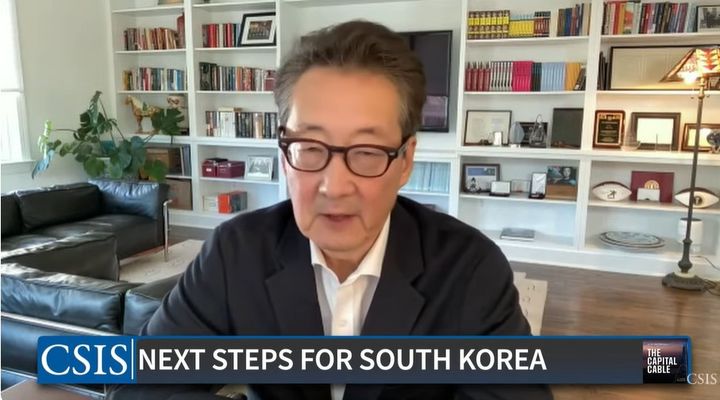
![[서울=뉴시스] HLB그룹 진양곤 회장(가운데)은 21일 온라인 기자간담회에서 발표했다. (사진=간담회 영상 캡처) 2025.03.21. photo@newsis.com *재판매 및 DB 금지](https://img1.newsis.com/2025/03/21/NISI20250321_0001797219_web.jpg?rnd=20250321100555)
[서울=뉴시스] HLB그룹 진양곤 회장(가운데)은 21일 온라인 기자간담회에서 발표했다. (사진=간담회 영상 캡처) 2025.03.21. photo@newsis.com
*재판매 및 DB 금지
[서울=뉴시스]송연주 기자 = 간암 신약의 미국 식품의약국(FDA)의 판매승인이 다시 한 번 좌초된 HLB가 2개월 내 재도전 해 빠르면 7월에 허가받을 수 있다고 언급했다.
진양곤 HLB그룹 회장은 21일 온라인 기자간담회에서 “FDA의 보완요구서신(CRL)에 담긴 보완 요청 사유는 파트너사 중국 항서제약의 면역항암제 ‘캄렐리주맙’ 공장 CMC(제조품질관리) 지적사항이 충분히 해소되지 않았기 때문”이라며 “5월에 보완 서류를 제출해 만약 심사 진행 관련 클래스1(Class1)으로 구분되면 2개월이 걸리므로 이르면 7월에는 결정날 것으로 기대한다”고 밝혔다.
이날 HLB는 간암신약에 대해 FDA가 다시 한 번 보완요청서를 발급함으로써, 일부 미비점에 대한 추가 보완이 필요하게 됐다고 밝힌 바 있다.
HLB는 자사 표적항암제 '리보세라닙'과 항서제약의 면역항암제 '캄렐리주맙' 병용요법을 미국에서 간암 1차 치료제로 허가받기 위해 추진해왔다. 앞서 작년 5월 첫 허가 신청에선 허가가 불발됐는데, 당시에도 FDA는 캄렐리주맙의 CMC에 대한 CRL을 발급한 바 있다.
진 회장은 “허가 불발에 대한 구체적 사유는 아직 확인되지 않는다. 캄렐리주맙의 CMC 부분인건 맞지만 어떤 부분이 충족 안 된건지 확인 안되는 것”이라며 “이를 파악하기 위해 항서제약이 빠르게 FDA에 서한을 보내면 FDA는 2~3주 내 항서제약에 알려줘야 하므로 그때 명확히 알 수 있을 것”이라고 말했다.
다만 “최근 실사에서 받은 3가지 지적사항 중 첫 번째인 ‘미생물 오염물을 방지하기 위한 멸균 프로토콜이 충분하지 않거나 준수되지 않고 있다’ 일 수 있다”며 “다른 2가지 지적사항은 사실상 기본적인 부분이라, 미흡한 점이 있었다면 해당 부분일 수 있다고 예상되지만 이건 항서제약이 시험운행으로 입증했기 때문에 FDA의 입장을 들어봐야 알 것 같다”고 말했다.
미중 갈등과 중국산 의약품에 대한 견제가 작용된 건 아닐 것으로 판단했다. 진 회장은 “지난 2~3년간, 지난달까지도 중국 바이오 회사가 개발하고 중국 공장에서 생산된 약이 줄줄이 FDA에서 승인받았다. 캄렐리주맙과 같은 PD-1 항체도 베이진 등이 승인받았다”며 “미중 갈등 영향은 없다고 단언한다”고 말했다.
유럽 진출 계획에 대해선 “유럽 허가신청은 7월에 진행될 것이고 이미 준비됐다”며 “다른 국가 진출은 FDA 승인이 빨리 나야 다른 국가에도 진출할 수 있어서 FDA에 재신청하도록 노력할 것”이라고 말했다.
진 회장은 “예상치 못한 보완요청을 받아 당황스럽고 주주들의 실망이 클 것 같아 죄송스럽다”며 “다만 이번 2차 CRL에 앞서 받은 지적사항은 3개로, 1차 10개에 비해 양적·질적면에서 훨씬 가벼운 사항이라 빠르게 극복 가능할 것이라고 생각한다”고 말했다.
◎공감언론 뉴시스 songyj@newsis.com
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지